Isınma-Soğuma Eğrileri
ISINMA - SOĞUMA EĞRİLERİ
İçinde bir miktar ve belli sıcaklıkta buz bulunan bir kap buzlar eriyip buharlaşıncaya kadar ısıtıldığında buzun tanecik modeli şekildeki gibi değişecektir.
İçinde bir miktar ve belli sıcaklıkta buz bulunan bir kap buzlar eriyip buharlaşıncaya kadar ısıtıldığında buzun tanecik modeli şekildeki gibi değişecektir.
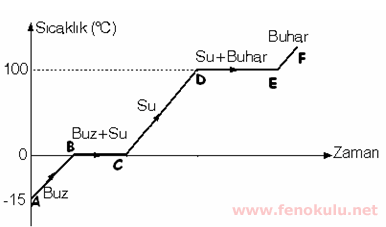
Grafikte sıcaklık 0 °C ve 100 °C de sabit kalmıştır. Sıcaklığın sabit kaldığı bu durumlarda madde hal değiştirmiştir. Yani 0 °C bu maddenin erime (donma) sıcaklığı; 100 °C ise bu maddenin buharlaşma (yoğunlaşma) sıcaklığıdır.
Grafiğimizi açıklayalım: A noktasında ısı alan buz taneciklerinin hareket enerjileri arttığından aralarındaki uzaklık artmıştır. A noktasından B noktasına doğru madde de sıcaklık artışı gözlenir. B noktasına yani, 0°C değerine gelindiği zaman erime başlar. Artık buz taneciklerinin aldığı ısı buzun erimesi için kullanılır. Burada B ve C noktaları arasında hal değişimi olduğu için maddenin sıcaklığı değişmeyecek, buzun aldığı ısı erimeye harcanacaktır. Ancak su sürekli ısı almaya devam ederse suyun aldığı bu ısı erime tamamlanınca suyun sıcaklığının yükselmesini sağlar. C ve D noktaları arasında suyun sıcaklığı hızla yükselir. Yükselen bu sıcaklık değeri 100 °C ‘ye ulaştığında sıcaklık yine sabit kalır. Alınan ısı tanecikler arasındaki bağları daha da zayıflatarak suyun artık buhar haline gelmesini sağlar. D noktasında buharlaşmaya başlayan su, E noktasında tamamen buhar olur. E noktasından itibaren su buharına verilen ısı onun sıcaklığının sabit kalmadan artmasına neden olur.
Isıtıcının gücü sıcaklık- zaman grafiğini nasıl etkiler? Cevap: Kabın içindeki maddenin değişmediğini dikkate alırsak Madde yine normal erime ve buharlaşma sıcaklığında eriyip-buharlaşacaktır. Sadece bu kez maddenin tamamen buharlaşması çok daha kısa sürecektir.
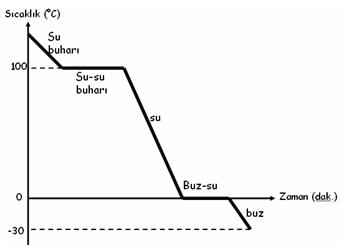
Buhar halinde bulunan su taneciklerinin hal değişim grafiği (gaz-sıvı katı):
Aşağıda A,B,C saf maddelerine ait bilgiler tabloda verilmiştir. Bu bilgileri kullanarak bu maddelere ait sıcaklık- zaman grafiklerini çizelim...
Erime - Donma - Buharlaşma – Yoğunlaşma Isısı
Erime ısısı: Erime sıcaklığına ulaşmış 1 gram saf katı maddenin tamamen erimesi için gerekli ısı miktarına erime ısısı denir. Hal değiştiren bir maddenin aldığı ısı enerjisi, maddenin tanecikleri arasındaki mesafeyi artırarak moleküller arasındaki çekim kuvvetinin azalmasını sağlar. Her maddenin tanecikleri arasındaki çekim kuvveti aynı değildir. Bu nedenle çekim kuvvetinin zayıflatılması için maddelere verilmesi gereken ısı miktarları da aynı olmayacaktır. Yani her maddenin erime ısısı birbirinden farklıdır. Bu nedenle erime ısısı maddeler için ayırt edici bir özelliktir.* Erime ısısı Le ile gösterilir. Birimi J/g’dır.
* Erime ısısı sadece erime sıcaklığındaki maddeler için söz konusudur. Örneğin buzun erime ısısı 334,4 J/g’dır. Bu ısı -20 ºC’deki bir buza verildiğinde buzun sıcaklığı artar ama buz erimez. Ancak aynı ise 0 ºC’deki buza verildiğinde buzun sıcaklığı artmaz ama erir. Buradan şöyle bir sonuç çıkıyor: Hal değiştiren bir maddenin sıcaklığı sabit kalır. Çünkü bu sırada maddeye verilen ısı, maddenin taneciklerinin birbirinden uzaklaştırılması için kullanılır.
* Bir miktar maddenin erimesi için gerekli ısıyı şu bağıntı ile hesaplayabiliriz:
Q= m x Le
Q= Erime için gerekli ısı enerjisi m =kütle Le =erime ısısı
Soru 1: Erime sıcaklığındaki 0,5 g kurşunu tamamen eritmek için gerekli ısı miktarı ne kadardır?(Kurşun Le= 22,5 J/g)
Soru 2: Erime sıcaklığındaki 5 g demiri tamamen sıvı hale getirmek için gereken ısı miktarı nedir?(Demir Le: 117,4 J/g)
Donma ısısı: Donma sıcaklığında bulunan 1 gram saf sıvı maddenin tamamen katı hale geçmesi için gerekli ısı miktarına donma ısısı denir Bir maddenin katı halden sıvı hale geçmesi için ısı alması gerekir. Sıvı halden katı hale geçen madde ise çevresine ısı verir. Donan maddenin çevresine verdiği ısı miktarı, erirken aldığı ısı miktarına eşittir. Yani bir maddenin donma ve erime ısıları birbirine eşittir. Ld şeklinde gösterilir. (Bir madde için Le = Ld)
Not: Farklı maddelerin erime ve donma ısıları birbirlerinden farklıdır. (örn: suyun erime ve donma ısısı birbirine eşittir ancak demir ve suyun erime(donma) ısıları birbirinden farklıdır.)
* Bir miktar maddenin donması için gerekli ısıyı şu bağıntı ile hesaplayabiliriz:
Q= m x Ld
Ld= donma ısısı
Soru 3: Donma ısısı 200 J/g olan bir maddenin X g miktarının donması için verilmesi gereken enerji 12.540.000 j ise X kaç g’dır?
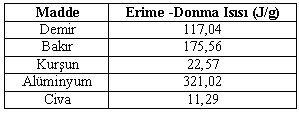
Bazı Maddelere Ait Erime-Donma Isısı Değerleri
Buharlaşma ısısı: Kaynama sıcaklığındaki 1 gram saf sıvıyı aynı sıcaklıktaki 1 gram buhar haline getirmek için gerekli
ısıdır. Lb ile gösterilir Sıvı halde bulunan bir maddenin gaz haline geçmesi olayına buharlaşma denir. Buharlaşma olayının gerçekleşmesi için maddenin ısıya ihtiyaç vardır. Maddenin aldığı bu ısı, tanecikler arasındaki bağların yok olacak kadar zayıflamasına neden olur ve tanecikler birbirinden bağımsız hale gelir. Bu sırada maddenin sıcaklığı değişmez. Sıvı buharlaşırken çevresinden ısı aldığı için ve çevresini soğutur.
Q = m x Lb
.
Yoğunlaşma ısısı:Gaz halindeki maddenin sıvı hale geçmesine yoğunlaşma denir. Kaynama sıcaklığında ve gaz halinde bulunan 1 gram maddenin, aynı sıcaklıkta tamamen sıvı hale geçerken çevresine verdiği ısıya yoğunlaşma ısısı denir. Ly ile gösterilir.
Q = m x Ly
Not. Sıvılar buharlaşırken aldıkları ısıyı yoğunlaşırken geri verirler. Kaynama sıcaklığındaki buhar yoğunlaşma ısısı kadar ısı kaybettiğinde sıvı haline geçer. Bu yüzden buharlaşma ısısı yoğunlaşma ısısına eşittir. Bir madde için Lb = Ly
Buharlaşma ve yoğunlaşma ısıları maddeler için ayırt edici özelliktir
Bazı Maddelere Ait Buharlaşma - Yoğunlaşma Isısı Değerleri

Soru 4: Kaynama sıcaklığında bulunan 100 g suyun yine aynı sıcaklıkta su buharı haline gelmesi için gereken ısı miktarı nedir? (Ly= 2257 J/g)
Hal Değiştiren Saf Olmayan Maddeler (Karışımlar)
* Saf bir maddeye eklenen farklı cins madde, saf maddenin kaynama noktasını yükseltir.
* Saf bir maddeye eklenen farklı cins madde, saf maddenin donma sıcaklığını düşürür.
* Saf olmayan maddelerin belirli erime-donma-buharlaşma-yoğunlaşma noktaları (sıcaklıkları) yoktur. Hal değiştirme sırasında bu tür maddelerin sıcaklıkları sürekli değişkendir.
Maddenin Halleri ve Isı Alış - Verişi

Madde atomlardan, atomlarsa elektron, proton ve nötronlardan oluşur.
Her maddenin atomunda bulunan elektron ve protonların özellikleri birbirlerinin aynıdır.
O zaman aklımıza şöyle bir soru geliyor.
Maddeler neden yalnızca katı, sıvı. gaz ya da plazma halinde değilde, böyle dört halde bulunuyorlar?
Bunun nedeni maddeyi meydana getiren atomların konumlarından kaynaklanıyor.
Maddeyi meydana getiren atomlar arasındaki çekim kuvveti çok büyükse, atomlar birbirleri ile çok sıkışık bir durumda duruyorlar ve bu maddenin katı olmasına neden oluyor.
Maddeyi meydana getiren atom ya da moleküller sıkışık, ancak birbirlerinin üzerinden kayabiliyorlarsa sıvı maddeleri meydana getiriyorlar.
Maddeyi meydana getiren moleküller her tarafa doğru hareket edebiliyorlarsa bu seferde gaz maddeler meydana geliyor.
Katı bir maddeye dışarıdan ısı vererek onun atom ya da molekülleri arasındaki çekim kuvvetini azaltarak sıvıya, sıvı haline yine dışarıdan ısı verdiğimizde gaz haline dönüştürebiliriz.
Bir katı maddenin sıvı hale, sıvı maddenin gaz haline dönüşmesine hal değişimi denir.
Maddelerin hal değiştirmesi için verilmesi gereken ısı miktarı birbirinden farklıdır.
ISI ALIŞ VERİŞİ
Sıcak bir cisimden soğuk bir cisme ısı akışı olur. Bu ısı akışı iki maddenin sıcaklıkları eşit olana kadar devam eder.
Burada dikkat edilmesi gereken konu ısı alış verişi yapan maddelerin kütlelerinin de birbirine yakın olması gerekir. Denize bir kova kaynar su döktüğünüzde, denizin sıcaklığının değişmeyeceğini hepiniz tahmin edersiniz.
Isı alış verişi doğada rüzgar oluşumunu da meydana getirir.
Sıcak cisimden soğuk cisme ısı akışı olduğunu nereden biliyoruz?
Sobanın üzerine su dolu çaydanlığı koyduğumuzda çaydanlığın içerisindeki suyun sıcaklığının arttığını gözlüyoruz. Tersi olsaydı sobanın sıcaklığının azalması gerekirdi.
Isı alış verişlerinde alınan ısı verilen ısıya eşittir.
Bu özellik bize ısı ile ilgili problemleri çözmemizde yardımcı olur.Enerji Dönüşümü ve Öz Isı
• Enerjinin birçok çeşidi vardır. Ve birçok enerji çeşidi birbirine dönüşmektedir.
• Bir elektrik ampulünde elektrik enerjisi ışık enerjisi dönüşürken aynı zamanda ısı enerjisi de açığa çıkar
• Bisiklete binildikten bir süre sonra aniden fren yapıldığında bisiklet tekerleklerinde sıcaklık açığa çıkar çünkü, mekanik enerji ısıya dönüşmüştür.
• Ütü, fırın, buzdolabı, çamaşır makinesi, bulaşık makinesi gibi araçlarda elektrik enerjisi ısı enerjisine dönüşür ve bu araçlar çeşitli alanlarda kullanılır.
• Hava serin olsa bile bir süre koştuktan sonra bunalmamızın sebebi: hareket enerjisinin ısıya dönüşmesidir.
• İki elinizi birbirine sürttüğünüzde ısınırsınız. Çünkü mekanik enerji, ısıya dönüşmektedir. ( birbirine sürtünen iki yüzeyde enerji dönüşümü gerçekleşir)
* Verilen örneklerden anlaşıldığı gibi maddelerin ısınması enerji dönüşümü ile gerçekleşir.
Öz ısı: Bir maddenin sıcaklığındaki artış madde miktarına bağlı olduğu gibi maddenin türüne de bağlıdır. Bir gram
maddenin sıcaklığını 1ºC artırmak için gerekli ısı miktarına o maddenin öz ısısı denir. 1 gram suyun sıcaklığını 1ºC
artırmak için gerekli ısı miktarı 1 kalori’dir. Bundan dolayı öz ısı cal/g ºC veya j/g ºC birimiyle ifade edilir. Bütün maddelerin öz ısıları farklıdır. Öz ısı madde miktarına bağlı olmayıp madde cinsine bağlı olduğundan maddeler için ayırt edici bir özelliktir. Öz ısı “c” sembolü ile gösterilir.
Çeşitli maddelerin öz ısıları

Isı Ve Sıcaklık
Sıcaklık: Madde moleküllerinin kütle merkezlerinin ortalama kinetik enerjisi sıcaklık olarak tanımlanır.
Sıcaklık termometre ile ölçülür. Termometreler suyun donma ve kaynama noktalarını referans alarak ölçümlendirilir. En çok kullanılan termometre birimi olan "santigrat derece" de suyun donma noktası "0" kaynama noktası ise "100" birim olarak kabul edilir.

Her hangi bir termometre birimi ile ölçülen değer aşağıdaki formül yardımıyla diğer birimlere dönüştürülebilir.
Isı: Bir maddenin bütün atom ve moleküllerinin kinetik ve potansiyel enerjilerinin toplamı o maddenin ısı dır
m = kütle
c = öz ısı
Öz ısı: Bir gramlık maddenin sıcaklığını bir derece arttırmak için gerekli olan ısı miktarı öz ısı alarak tanımlanır.
Hal Değiştirme: Bir maddenin katı, sıvı ve gaz halleri arasında geçişler yapmasına hal değiştirme denir.

Kaynama Noktası: Sıvı haldeki bir maddenin kaynaması için gerekli olan sıcaklık değeri.
Yoğunlaşma Noktası: Gaz haldeki bir maddenin sıvı hale geçebilmesi için gerekli olan sıcaklık değeri.
Erime Noktası: Katı haldeki bir maddenin sıvı hale geçebilmesi için gerekli olan sıcaklık değeri.
Donma Noktası: Sıvı haldeki bir maddenin katı hale geçebilmesi için gerekli olan sıcaklık değeri.
Hal değişimi sırasında erime ve kaynama noktalarında bir süre sıcaklık değişmez alınan ısı moleküllerin arasındaki bağları çözmek için harcanır. Bu noktalarda harcanan enerji aşağıdaki gibi hesaplanır.
Q = m.L
Q = ısım = kütle
L = Bu harlaşma yada erime erime ısı.
Hal değişiminde yukarıda anlatılan süre dışında harcanan ısı enerjisi miktarı aşağıdaki formül ile hesaplanır.
m = kütle
c = öz ısı

0 yorum:
Yorum Gönder